|
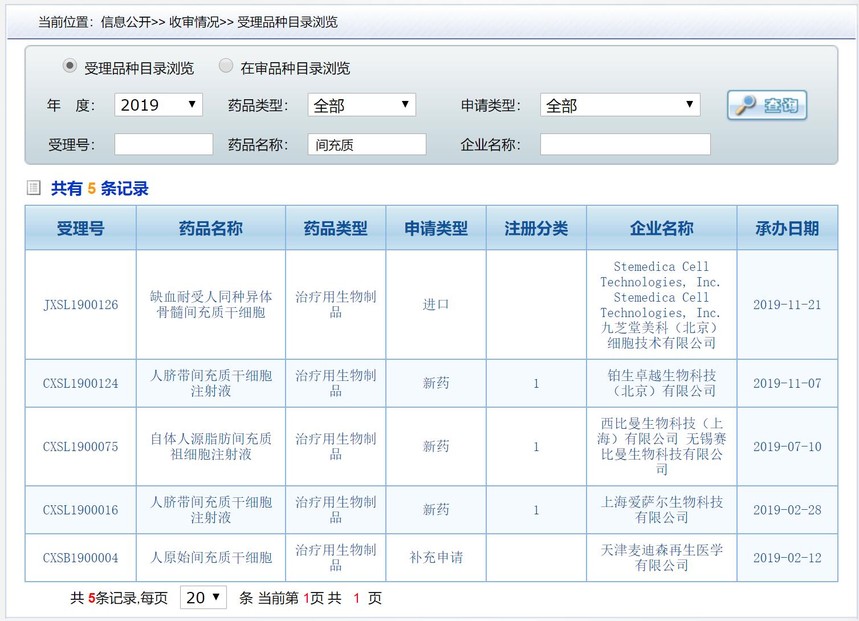
中国间充质干细胞类药物受理与许可一览时间:2019-11-22 2019年11月21日,首个进口间充质干细胞药物获得IND受理。该申请由九芝堂美科(北京)细胞技术有限公司提交,药品名称为“缺血耐受人同种异体骨髓间充质干细胞”(受理号: JXSL1900126)。 美国Stemedica公司制备的干细胞符合美国FDA cGMP 标准,已在美国开展6项临床试验,已完成两个适应症的I/IIa期研究,其中使用人骨髓间充质干细胞治疗缺血性卒中的I/IIa期临床试验顺利达到主要终点和次要终点,初步证明了安全性和有效性。近日,该研究论文发表在国际卒中领域专业期刊《Stroke》上,给临床医生提供了新的治疗思路,也为脑卒中患者带来了康复希望。
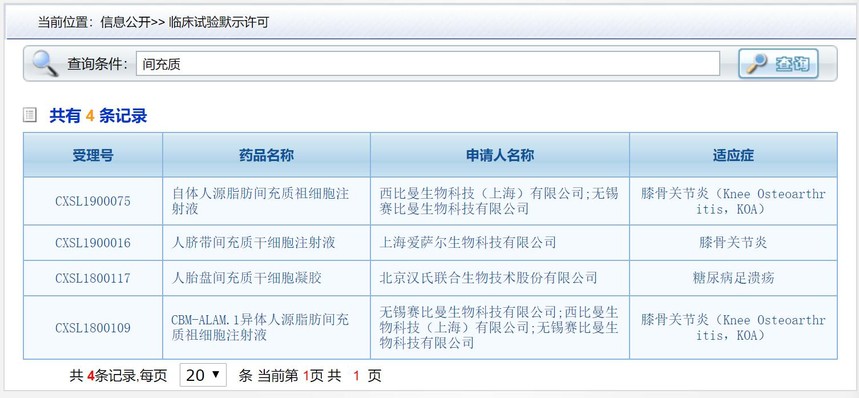
这里再次梳理截止目前CDE对间充质干细胞药物受理和审核情况。 目前,许可开展临床研究的间充质干细胞有4个,详情见下图。
2019年IND受理的共5个,包括刚刚受理的进口产品,其中已经通过审核获准临床研究的2个,受理详情见下图。
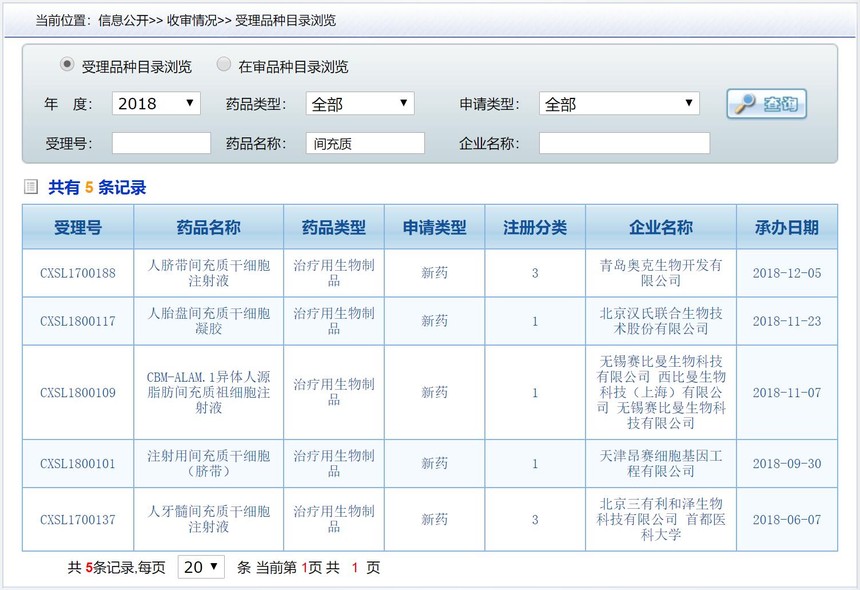
2018年,受理5个,其中通过审批的2个,受理详情见下图。
回顾间充质干细胞药物在中国药品的情况,最早可追溯到2004年。然而,各种原因导致直到14年后的2018年,才有了真正意义上的临床许可。IND受理详情见下图。
|