|

收藏
产品编号 RC200101
推荐搭配
产品信息 产品名称:人间充质干细胞无血清培养基 货号: RC200101 批号:见包装 试剂清单:
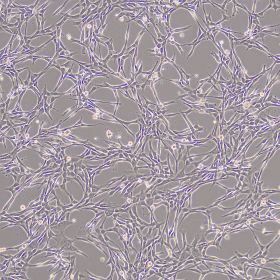
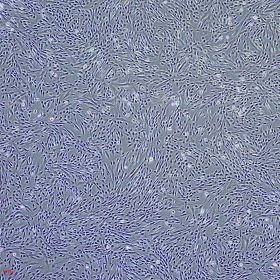
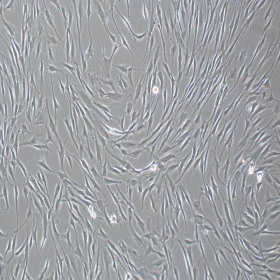
存储与有效期: 组分A于2-8 ℃保存,组分B于-20 ℃保存。所有组分均须避免反复冻融及复温,各组分在所需要的温度下有效期为1年,配制完成的完全培养基于2-8 ℃保存,稳定储存2-3周。 适用细胞: 适用于人骨髓、脂肪、脐带等组织来源的间充质干细胞的原代分离、扩增与传代培养。 产品介绍 人间充质干细胞无血清培养基是一款化学成分完全明确的人间充质干细胞培养基。可应用于人脐带、脂肪、骨髓、羊膜、气管等组织来源的间充质干细胞(MSC)的原代分离培养、传代与扩增培养,并保持MSC的生物学特性及分化潜能。因为化学成分完全明确,在许多方面具有明显优势。安全性上,有效避免了人、动物等原料带来的病原体污染,从根源上解决了核酸病毒、朊病毒和未知传染性疾病带来的风险问题。应用场景上适用更广,即可以满足细胞培养扩增,又能让科学研究更为稳定和避免未知不稳定因素带来的干扰,也能适用于外泌体提取和研究。 产品特性:化学成分完全明确;无需促进贴壁包被;可用于原代与传代培养;适用多种组织来源的间充质干细胞;扩增效率稳定,可稳定传代约20代,倍增时间约为24小时(因细胞来源而有差异)。 该产品的主要成分有:无机盐、维生素、氨基酸、白蛋白、转铁蛋白、胰岛素、细胞因子、其他微量元素等。 操作方法 实验准备 u 人间充质干细胞完全培养基配制: 1. 添加剂处理:2-8℃解冻人间充质干细胞培养基添加剂(RC200101-B),时间约为过夜放置。添加剂融化后轻轻充分摇匀,分装或直接按比例添加到基础培养基中,分装后添加剂立即存储于-20 ℃至-80℃,避免反复冻融。 注意:若使用37℃快速融化有可能会出现絮状沉淀,建议采用2-8℃慢速融化。若出现类似沉淀物,请务必充分混匀,以保证添加的均匀度。 2. 完全培养基配制:将添加剂以10%比例加入到人间充质干细胞基础培养基(RC200101-A)中,充分混匀,即配制成人间充质干细胞完全培养基(RC200101)。完全培养基在2-8℃可稳定储存2-3周,超过3周的完全培养基请谨慎使用。 注意:混合成人间充质干细胞培养基后必须充分混匀,2-8℃保存。整个过程确保无菌操作,各试剂开封前以75%酒精擦拭表面。完全培养基使用前务必室温复温至少30分钟,该操作适用于下列所有用到完全培养基的步骤。 u 自备试剂: l 消化液(0.125%Trypsin-0.04%EDTA或其他) l 无钙镁的磷酸盐缓冲液(DPBS) l 细胞冻存液 操作方法(参考,请根据各自实验需求自行制定操作规程) u u 原代细胞培养(羊水、全血、全骨髓培养发法、酶消化法): 1. 该部分以单细胞悬液为操作起始。单细胞获取方式包括但不限于使用胰酶、胶原酶、分散酶等酶消化法(推荐使用组织细胞消化液RC200104)从脂肪、脐带、羊膜、皮肤等组织获得;使用离心法直接从羊水、全血、全骨髓获得。 2. 原代接种:以上方法获得的细胞沉淀,漩涡震荡使其分散为单个细胞,加入适量的完全培养基,充分混匀。200 g离心5-10分钟。弃去上清,漩涡震荡使沉淀分散为单个细胞,加入适量的完全培养基,充分混匀。按照一定的细胞密度接种于培养器皿中。37℃、5%CO2、饱和湿度静置培养48小时。该时间段内请勿移动培养器皿,也无需观察。48小时后观察细胞,根据情况选择半量或全量更换新鲜完全培养基。 3. 换液培养:后每48小时更换新鲜培养基。观察细胞,弃去原培养上清。若悬浮细胞较多,则可用DPBS轻轻洗涤细胞1-2次。添加新鲜完全培养基继续培养。 4. 传代:原代细胞传代以克隆大小和克隆中心细胞密度为标准。若克隆中心细胞密度较大,则不论整个培养器皿是否长满均应进行传代操作。弃去培养上清,加入适量的DPBS,轻轻晃动后弃去DPBS,重复洗涤2-3次。加入适量的0.125%胰蛋白酶消化液室温消化2分钟,加入2倍体积的完全培养基终止消化。用移液管、吸管或移液枪头等轻轻吹打细胞,使细胞从培养器皿表面脱落、分散。将细胞悬液移入离心管中,水平离心机200 g离心5分钟。弃去上清,漩涡震荡分散细胞,加入适量的完全培养基,再次漩涡震荡均匀悬浮细胞。按照1:3-1:6的比例接种到新的培养器皿中,继续培养。后续传代间隔为3-5天。 注意:足量的胰酶消化,室温消化不宜超过2分钟。注意胰酶浓度和活性的关系,降低胰酶浓度是避免消化过度导致传代后细胞状态下降的有效方法之一。吹打细胞时也不宜力量过大,轻轻吹打即可,不脱落细胞直接丢弃;吹打细胞对细胞活性影响较大,尽量轻柔和减少吹打次数,尽量选用震荡等不直接接触细胞的方式分散细胞。 5. 冻存:参照下述“hMSC细胞冻存”。 u u 原代细胞培养(组织块法): 1. 该部分以组织块作为起始。组织块包括但不限于脐带、羊膜、皮肤等来源的切成1-3 mm3大小的组织块。 2. 原代接种:用缓冲液清洗过的组织块,用适量的完全培养基悬浮,300目无菌滤网过滤或200 g离心5-10分钟,收集组织块。用适量的完全培养基重新悬浮组织块,均匀接种于培养器皿中,37℃、5%CO2、饱和湿度静置培养。48小时内最好不要对培养器皿进行任何移动。 3. 换液:48小时后进行半量或全量更换新鲜完全培养基,具体视情况而定。每2天更换新鲜培养液。组织块周围有密度较高的细胞时,可以选择去除组织块。 4. 传代:参照上述“传代”方法。 5. 冻存:参照下述“hMSC细胞冻存”。 注意:组织块法培养原代周期较长,细胞爬出时对培养器皿表面贴壁性要求高,可以使用促贴壁的包被液进行预处理。 u hMSC细胞传代培养(非原代): 1. 在显微镜下观察细胞,当细胞融合度达到90%,即可传代。 2. 弃去培养上清,加入DPBS溶液清洗1次,加入细胞消化液使其完全覆盖培养器皿底部。 3. 室温孵育1分钟,轻轻拍打培养器皿,显微镜下观察大部分细胞从培养器皿底部脱落后立即停止消化。 4. 加入消化液2倍体积的人间充质干细胞完全培养基,用移液器轻轻吹打培养器皿表面未完全脱离的细胞,使细胞完全脱落并均匀分散。 5. 将细胞悬液转移到离心管中,200 g离心5分钟。 6. 弃上清,加入完全培养基,重悬细胞,计数。1:3-1:6比例传代,均匀铺在培养器皿中,置于37℃、5%CO2、饱和湿度培养箱中培养。 注意:可以调整传代比,使传代天数间隔在3-4天。培养48小时必须更换新鲜培养基。 u hMSC细胞复苏: 1. 从液氮中取出冻存的hMSC细胞,迅速将冻存管/冻存袋放入复苏装置或37℃水浴快速融化。 2. 将解冻后的细胞悬液缓慢加入适量完全培养基(冻存体积与培养基的体积比为1:5-1:10)。 3. 200 g离心5分钟,弃去上清,加入适量的完全培养基重悬细胞。 4. 将细胞均匀铺到培养器皿中,摇动培养器皿使细胞均匀分布,37℃、5%CO2、饱和湿度培养,24小时后观察细胞状态。 5. 24小时后更换新鲜完全培养基继续培养,以后每2天更换新鲜完全培养基。 注意:细胞传代所需的时间:2-4天。hMSC消化极易过度,若使用0.25%胰酶消化液可以稀释一倍,且严格控制消化时间。 u hMSC细胞冻存 1. 细胞达到90%汇合度,弃去原有培养基,DPBS清洗1次。 2. 加入细胞消化液使其完全覆盖培养器皿底部,室温孵育1分钟,轻轻拍动培养器皿,显微镜下观察大部分细胞从培养器皿底部脱落后立即停止消化。 3. 加入消化液2倍体积的人间充质干细胞完全培养基,用移液器轻轻吹打培养器皿地面未完全脱离的细胞,使细胞完全脱落并均匀分散。 4. 将细胞悬液转移到离心管中,200 g离心5分钟,弃去上清。 5. 加入适量细胞冻存液,调整细胞冻存密度在1×106 cells/cm2左右,每支冻存管分装0.5-1 ml,使用冻存袋冻存请自行根据需要选择冻存方案。 6. 程序降温仪冻存,或放入冻存盒然后置于-80℃或直接放入-80℃,24小时后转入液氮中长期保存。 注意:此处消化液为胰酶消化液。细胞冻存方法有多种,此处介绍的冻存方法为含有DMSO的冻存方式。其他冻存方式请根据需要自行选择。 特别提示:以上所有操作均在无菌细胞培养室进行,细胞开放操作要在生物安全柜内进行;培养器皿包括培养皿、培养瓶、培养板、细胞工厂等,请根据实验需要自行选择,部分品牌或批次的培养器皿表面可能导致细胞贴壁不稳,进而细胞脱壁后成球生长,可以更换培养器皿或进行促贴壁包被处理;hMSC切忌消化过度,过度的消化会导致细胞快速老化,且失去部分或全部分化能力;实验室具体可操作的传代次数请自行分析判断,并建议以分化能力进行判别;该培养基仅用于hMSC细胞培养,操作规程仅作为参考。
文献引用
相关产品
|