|
| 货号 | 产品名称 | 目录价(元) | FY200006
| 人间充质干细胞成骨诱导试剂盒 | 1080 | | FY200007 | 人间充质干细胞成脂诱导试剂盒 | 1380 | | FY200008 | 人间充质干细胞成软骨诱导试剂盒 | 1780 |
产品特点:
小包装。采用100ml装,使用更节约、更方便; 简约装,升级产品、组成更简洁、操作更方便; 更稳定,产品系统误差更小,使用更稳定。 适用研究:人间充质干细胞分化能力鉴定,软骨再生医学与组织工程研究,人间充质干细胞产品质量控制,材料学研究,发育研究
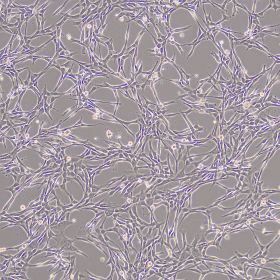
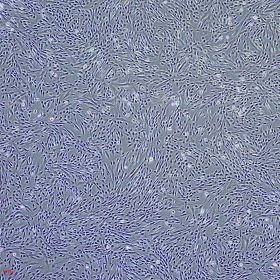
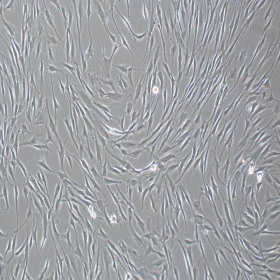
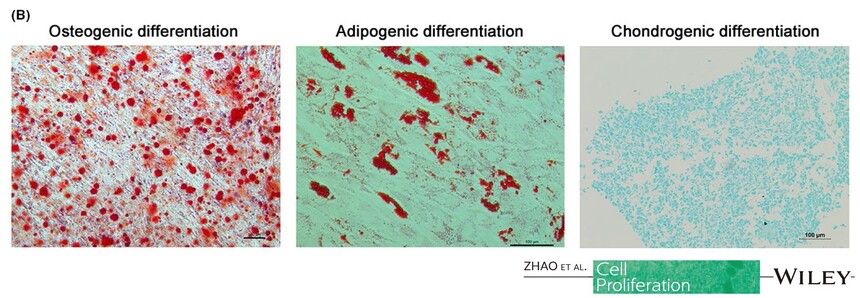
适用细胞:人骨髓、脂肪、脐带、羊膜间、牙髓、脐带血间充质干细胞,其他组织来源的人间充质干细胞。大鼠、犬、小鼠等其他物种来源的间充质干细胞。 诱导周期:1-4周 判定方法:阿利新蓝染色
产品使用效果图: 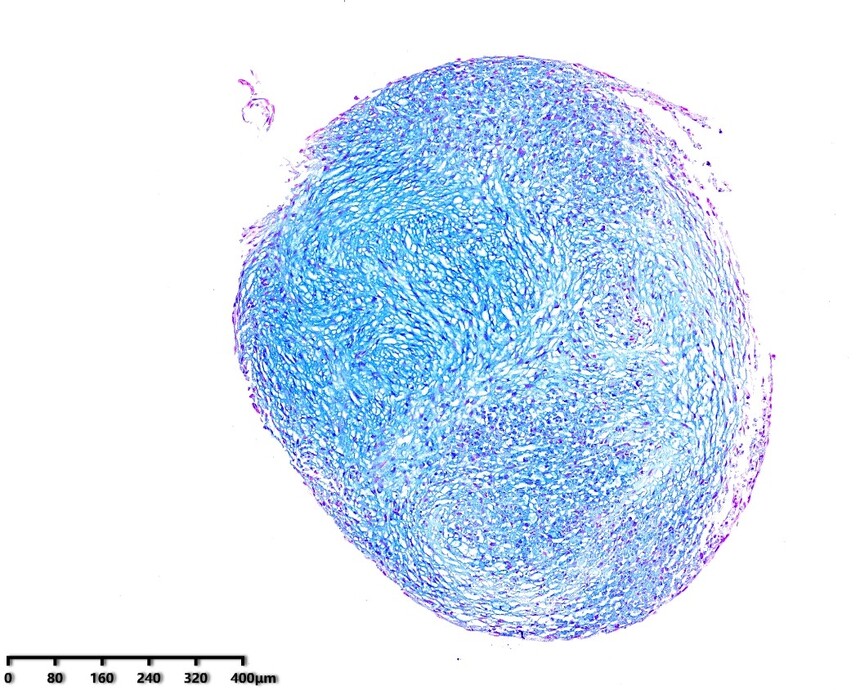 
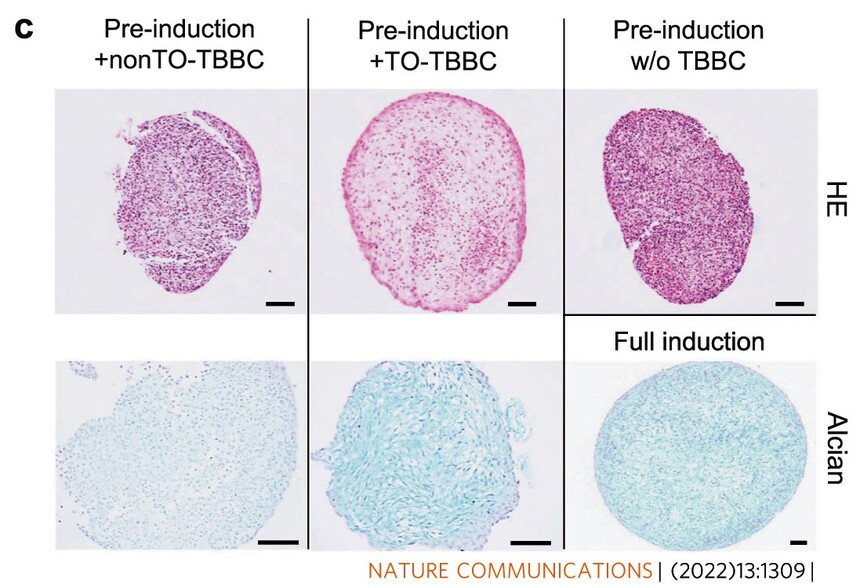
文献引用: Hong Y, Shan S, Gu Y, Huang H, Zhang Q, Han Y, Dong Y, Liu Z, Huang M, Ren T. Malfunction of airway basal stem cells plays a crucial role in pathophysiology of tracheobronchopathia osteoplastica. Nat Commun. 2022 Mar 14;13(1):1309. Zhao ZH, Ma XL, Ma JX, Kang JY, Zhang Y, Guo Y. Sustained release of naringin from silk-fibroin-nanohydroxyapatite scaffold for the enhancement of bone regeneration. Mater Today Bio. 2022 Jan 23;13:100206. Shen J, Wu X, Zhu P, Zhuang J, Qin B, Sun F, Yuan W, Fan X, Jiang Z, Li F, Li Y, Wang Y, Zhao M. Overexpression of PYGO1 promotes early cardiac lineage development in human umbilical cord mesenchymal stromal/stem cells by activating the Wnt/β-catenin pathway. Hum Cell. 2022 Nov;35(6):1722-1735. Sun J, Zhang F, Luo X, Shi G, Li F, Zheng B, Guo Y, Shi J, Li L. Long noncoding RNA AC092155 facilitates osteogenic differentiation of adipose-derived stem cells through the miR-143-3p/STMN1 axis. J Gene Med. 2021 Aug;23(8):e3363. Zhao ZH, Ma XL, Zhao B, Tian P, Ma JX, Kang JY, Zhang Y, Guo Y, Sun L. Naringin-inlaid silk fibroin/hydroxyapatite scaffold enhances human umbilical cord-derived mesenchymal stem cell-based bone regeneration. Cell Prolif. 2021 Jul;54(7):e13043. doi: 10.1111/cpr.13043. Epub 2021 May 19. PMID: 34008897; PMCID: PMC8249788. Xu Y, Jiang Y, Wang Y, Ren Y, Zhao Z, Wang T, Li T. LINC00473 regulated apoptosis, proliferation and migration but could not reverse cell cycle arrest of human bone marrow mesenchymal stem cells induced by a high-dosage of dexamethasone. Stem Cell Res. 2020 Oct;48:101954. doi: 10.1016/j.scr.2020.101954. Epub 2020 Aug 11. PMID: 32829248. 吕云,王立生.诱导多能干细胞来源的间充质干细胞的生物学特性[J].中国实验血液学杂志,2019,27(04):1253-1258. 张娇;邹翠云;张蓓;江福能;钟惟德;朱建国. 一种可控永生化的逆转录病毒载体和人脐带间充质干细胞及其构建方法[P]. 中国专利:CN201910267989.5,2019-04-03
引用文献示例(成骨、成脂、成软骨) 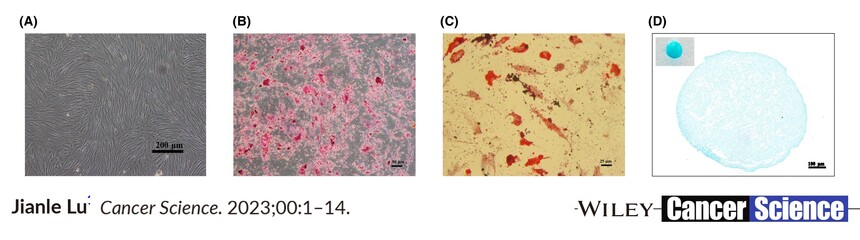
另外,弗元生物还可提供相应的技术服务,欢迎咨询。
|
|