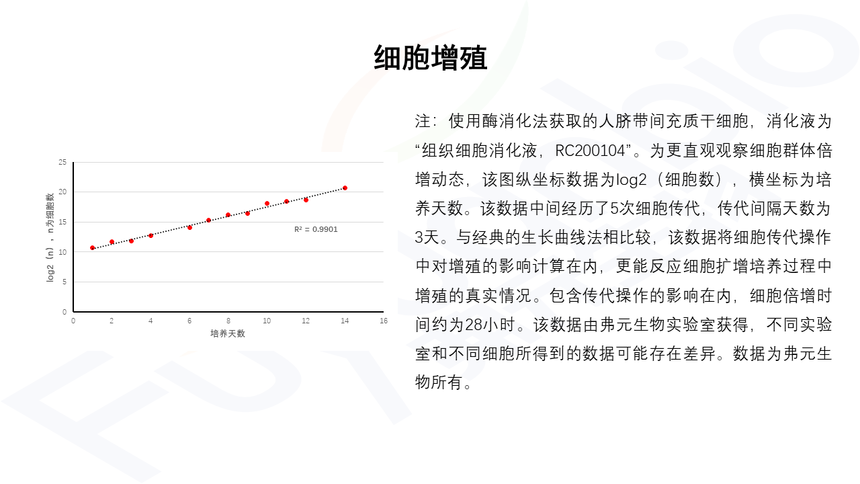
|

收藏
产品编号 RC200136
产品信息 产品名称:人脐带间充质干细胞无血清培养基 货号:RC200136 批号:见包装 试剂清单:
存储与有效期: 组分A于2-8℃保存,组分B于-20℃保存。所有组分均须避免反复冻融及复温,各组分在所需要的温度下有效期为1年,配制完成的完全培养基于2-8℃保存,稳定储存2-3周。 适用细胞: 适用于人脐带间充质干细胞的原代分离、扩增与传代培养。 产品介绍 人脐带间充质干细胞培养基是一款化学成分明确的新一代培养基,专门为人脐带间充质干细胞(hUMSC)培养设计,能够支持人脐带间充质干细胞生长、扩增,无需培养表面包被就能让细胞较好地贴壁,可有效延缓细胞在体外培养时的老化。可用于人脐带充质干细胞的原代分离、扩增与传代培养,并保持人脐带间充质干细胞的多种生物学特性及多向分化潜能,培养的人脐带间充质干细胞具有成骨、成脂、成软骨的分化能力,正常人脐带间充质干细胞表达CD73、CD90、CD105、CD166,不表达CD11b、CD31、CD34、CD45和HLA-DR。人脐带间充质干细胞在此培养基条件下可稳定传代约20代,但不具有无限传代能力。 操作方法 实验准备 u 人脐带间充质干细胞完全培养基配制: 1. 添加剂处理:室温解冻人脐带间充质干细胞培养基添加剂(FY200013-B)。添加剂融化后轻轻充分摇匀,分装或直接按比例添加到基础培养基中,分装后添加剂立即存储于-20℃至-80℃,避免反复冻融。 注意:添加剂解冻不可加热,建议采用室温溶解。 2. 完全培养基配制:将添加剂以10%比例加入到人脐带间充质干细胞基础培养基(FY200013-A)中,充分混匀,即配制成人脐带间充质干细胞完全培养基(FY200013)。完全培养基在2-8℃可稳定储存2-3周,超过3周的完全培养基请谨慎使用。 注意:混合成人脐带间充质干细胞培养基后必须充分混匀,2-8℃保存。整个过程确保无菌操作,各试剂开封前以75%酒精擦拭表面。完全培养基使用前务必室温复温至少30分钟,该操作适用于下列所有用到完全培养基的步骤。 u 自备试剂: l 消化液(0.25%Trypsin-0.04%EDTA或其他) l 无钙镁的磷酸盐缓冲液(DPBS) l 细胞冻存液 操作方法(仅供参考,请根据各自实验需求自行制定操作规程) u 原代细胞培养(酶消化法): 1. 该部分以单细胞悬液为操作起始。使用胰酶、胶原酶、分散酶等酶消化法(推荐使用组织细胞消化液RC200104)从人脐带华通氏胶组织获得。 2. 原代接种:以上获得的细胞沉淀,漩涡震荡使其分散为单个细胞,加入适量的完全培养基,充分混匀。200 g离心5-10分钟。弃去上清,漩涡震荡使沉淀分散为单个细胞,加入适量的完全培养基,充分混匀。按照一定的细胞密度接种与培养器皿中。37℃、5%CO2、饱和湿度静置培养48小时。该时间段内请勿移动培养器皿,也无需观察。48小时后观察细胞,根据情况选择半量或全量更换新鲜完全培养基。 注意:细胞培养务必选择合适的贴壁细胞培养器皿,若培养器皿不合适则严重影响细胞的贴壁、增殖甚至存活。 3. 换液培养:后每48小时更换新鲜培养基。观察细胞,弃去原培养上清。若悬浮细胞较多,则可用DPBS轻轻洗涤细胞1-2次。添加新鲜完全培养基继续培养。 4. 传代:原代细胞传代以克隆大小和克隆中心细胞密度为标准。若克隆中心细胞密度较大,则不论整个培养器皿是否长满均应进行传代操作。弃去培养上清,加入适量的DPBS,轻轻晃动后弃去DPBS,重复洗涤2-3次。加入适量的0.25%胰蛋白酶消化液(推荐使用间充质干细胞消化液,RC200108)室温消化2分钟,加入5倍体积的完全培养基终止消化。用移液管、吸管或移液枪头等轻轻吹打细胞,使细胞从培养皿表面脱落。 注意:足量的胰酶消化,室温消化不宜超过2分钟,吹打细胞时也不宜力量过大,轻轻吹打即可,不脱落细胞直接丢弃。 5. 冻存:参照下述“hUMSC细胞冻存”。 u 原代细胞培养(组织块法): 1. 该部分以组织块作为起始。组织块为脐带华通氏胶切成1-3 mm3大小的组织块。 2. 原代接种:用缓冲液清洗过的组织块,用适量的完全培养基悬浮,300目无菌滤网过滤或200 g离心5-10分钟,收集组织块。用适量的完全培养基重新悬浮组织块,均匀接种于培养器皿中,37℃、5%CO2、饱和湿度静置培养。48小时内最好不要对培养器皿进行任何移动。 3. 换液:48小时后进行半量或全量更换新鲜完全培养基,具体视情况而定。每2天更换新鲜培养液。组织块周围有密度较高的细胞时,可以选择去除组织块。 4. 传代:参照上述“传代”方法。 5. 冻存:参照下述“hUMSC细胞冻存”。 u hUMSC细胞传代培养(非原代): 1. 在显微镜下观察细胞,当细胞融合度达到90%,即可传代。 2. 弃去培养上清,加入DPBS溶液清洗1次,加入细胞消化液(推荐使用间充质干细胞消化液,RC200108)使其完全覆盖培养器皿底部。 3. 室温孵育1-2分钟,轻轻拍打培养器皿,显微镜下观察大部分细胞从培养器皿底部脱落后立即停止消化。 4. 加入消化液2倍体积的人间充质干细胞完全培养基,用移液器轻轻吹打培养器皿表面未完全脱离的细胞,使细胞完全脱落并均匀分散。 5. 将细胞悬液转移到离心管中,200 g离心5分钟。 6. 弃上清,加入完全培养基,重悬细胞,计数。1:3-1:6比例传代,均匀铺在培养器皿中,置于37℃、5%CO2、饱和湿度培养箱中培养。 u hUMSC细胞复苏: 1. 从液氮中取出冻存的hUMSC细胞,迅速将冻存管/冻存袋放入复苏装置或37℃水浴快速融化。 2. 将解冻后的细胞悬液缓慢加入适量完全培养基(冻存体积与培养基的体积比为1:5-1:10)。 3. 200 g离心5分钟,弃去上清,加入适量的完全培养基重悬细胞。 4. 将细胞均匀铺到培养器皿中,摇动培养器皿使细胞均匀分布,37℃、5%CO2、饱和湿度培养,24小时后观察细胞状态。 5. 24小时后更换新鲜完全培养基继续培养,以后每2天更换新鲜完全培养基。 注意:细胞传代所需的时间:2-4天。hUMSC消化极易过度,建议稀释0.25%胰酶消化液一倍,且严格控制消化时间,消化时长从细胞接触胰酶开始不宜超过2分钟。 u hUMSC细胞冻存 1. 细胞达到90%汇合度,弃去原有培养基,DPBS清洗1次。 2. 加入细胞消化液(推荐使用间充质干细胞消化液,RC200108)使其完全覆盖培养器皿底部,室温孵育1-2分钟,轻轻拍动培养器皿,显微镜下观察大部分细胞从培养器皿底部脱落后立即停止消化。 3. 加入消化液2倍体积的人间充质干细胞完全培养基,用移液器轻轻吹打培养器皿地面未完全脱离的细胞,使细胞完全脱落并均匀分散。 4. 将细胞悬液转移到离心管中,200 g离心5分钟,弃去上清。 5. 加入适量细胞冻存液(推荐使用细胞冻存液Ⅱ,RC200106),调整细胞冻存密度在1×106 cells/cm2左右,每支冻存管分装0.5-1 ml,使用冻存袋冻存请自行根据需要选择冻存方案。 6. 程序降温仪冻存,或放入冻存盒然后置于-80℃或直接放入-80℃,24小时后转入液氮中长期保存。 注意:此处消化液为胰酶消化液。细胞冻存方法有多种,此处介绍的冻存方法为含有DMSO的冻存方式。其他冻存方式请根据需要自行选择。 特别提示:以上所有操作均在无菌细胞培养室进行,细胞开放操作要在生物安全柜内进行;培养器皿包括培养皿、培养瓶、培养板、细胞工厂等,请根据实验需要自行选择;hUMSC切忌消化过度,过度的消化会导致细胞快速老化,且失去部分或全部分化能力;实验室具体可操作的传代次数请自行分析判断,并建议以分化能力进行判别;该培养基仅用于hUMSC细胞培养,操作规程仅作为参考。
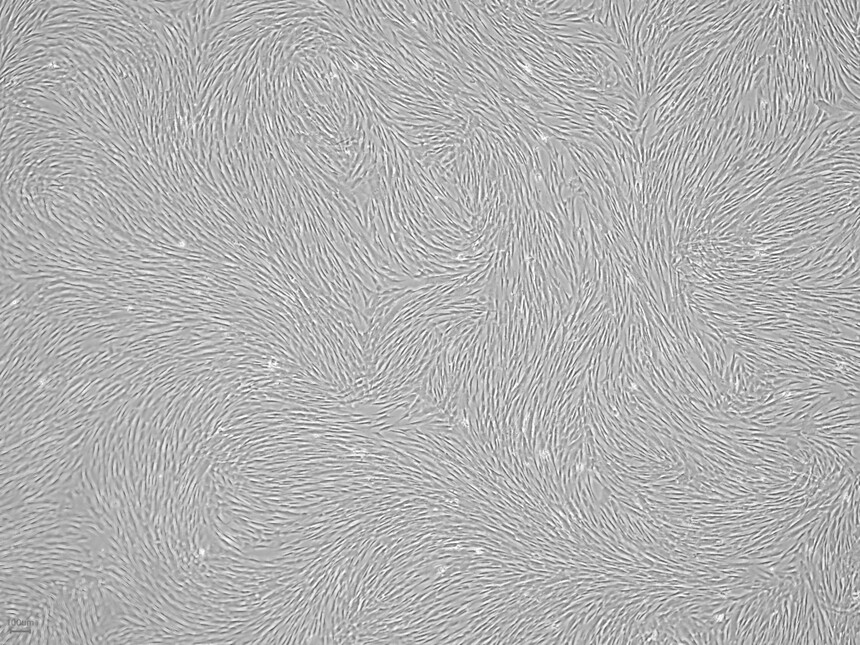
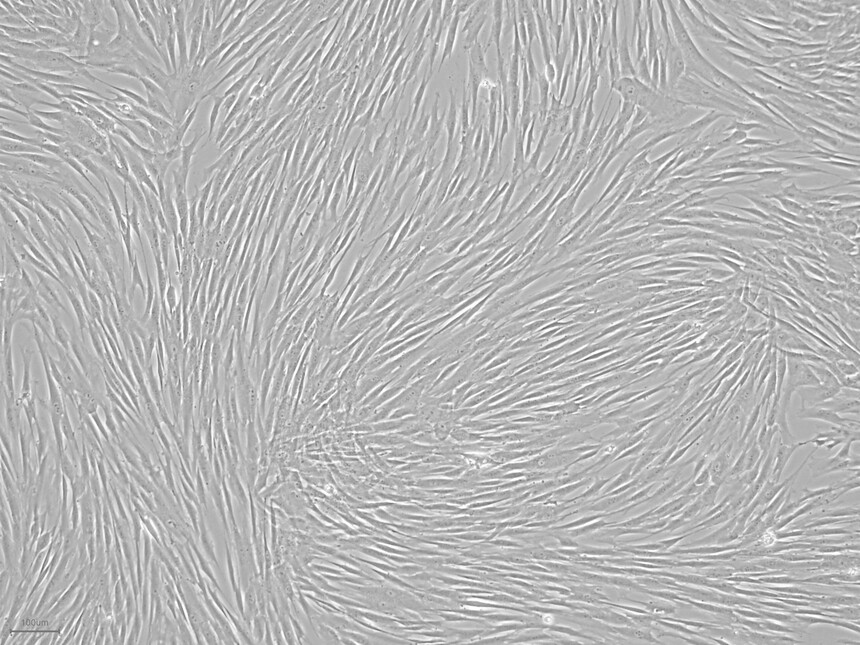
细胞形态展示:
|